Innhold
Den prosentvise massen bestemmer prosentandelen av hvert grunnstoff som danner en kjemisk forbindelse. For å finne denne verdien, trenger du molarmassen av de sammensatte elementene i gram / mol eller antall gram som brukes til å lage løsningen. Den prosentvise massen kan beregnes på en enkel måte ved hjelp av en grunnformel som deler massen til elementet (eller oppløst stoff) med massen av forbindelsen (eller løsningen).
Fremgangsmåte
Metode 1 av 2: Finne den prosentvise massen med gitte masser
- Definer ligningen for den prosentvise massen til en forbindelse. Den grunnleggende formelen for en forbindelse er: prosentmasse = () x 100. Du må multiplisere resultatet med 100 på slutten for å uttrykke verdiene som prosenter.
- Massen til en kjemisk forbindelse som du er interessert i, er massen gitt i problemet. Hvis denne verdien ikke er oppgitt, se følgende metode og lær hvordan du finner den prosentvise massen når massen ikke er gitt.
- Den totale massen av en forbindelse beregnes ved å legge til massene til alle elementene som brukes til å lage forbindelsen eller løsningen.
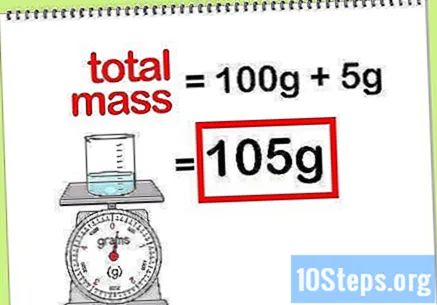
Beregn den totale massen av forbindelsen. Når du vet masseverdien til alle elementene eller forbindelsene som tilsettes, trenger du bare å legge dem sammen for å beregne massen av forbindelsen eller den endelige løsningen. Denne verdien vil være nevneren i beregningen av prosentmassen.- For eksempel: Hva er den prosentvise massen av 5 g natriumhydroksid oppløst i 100 g vann?
- Den totale massen av forbindelsen er mengden natriumperoksid pluss mengden vann: 100 g + 5 g, totalt en masse på 105 g.

Identifiser massen til det aktuelle kjemikaliet. Når du trenger å finne prosentmasse, vil problemet at du skal finne massen til et bestemt element (det aktuelle elementet) i prosent av den totale massen til alle elementene. Legg merke til massen til det aktuelle elementet. Denne verdien vil være telleren i beregningen av den prosentvise massen.- For eksempel er massen av elementet 5 g natriumhydroksid.
- Erstatt variablene i den prosentvise masseformelen. Etter å ha bestemt verdiene for hver variabel, erstatt dem i ligningen.
- For eksempel: prosentmasse = () x 100 = () x 100.

Beregn den prosentvise massen. Nå som ligningen er dannet, er det bare å løse den for å beregne den prosentvise massen. Del massen til elementet med den totale massen av forbindelsen og multipliser med 100. Resultatet vil være den prosentvise massen til det kjemiske elementet.- For eksempel: () x 100 = 0,04761 x 100 = 4,751%. Dermed er den prosentvise massen av 5 g natriumhydroksyd oppløst i 100 g vann 4,751%.
Metode 2 av 2: Finne den prosentvise massen med ikke oppgitte masser
- Definer ligningen for den prosentvise massen til en forbindelse. Den grunnleggende formelen for den prosentvise massen til en forbindelse er: prosentmasse = () x 100. Du må multiplisere resultatet med 100 på slutten for å uttrykke verdiene i prosent.
- Når du ikke kjenner til masseverdiene, kan du finne den prosentvise massen til et element av forbindelsen ved hjelp av molmassen.
- For eksempel: Hva er den prosentvise massen av hydrogen i et vannmolekyl?.
Skrive den kjemisk formel. Hvis kjemiske formler for hver forbindelse ikke er gitt, må du skrive dem ned. Gå ellers til trinn "Finn massen til hvert element".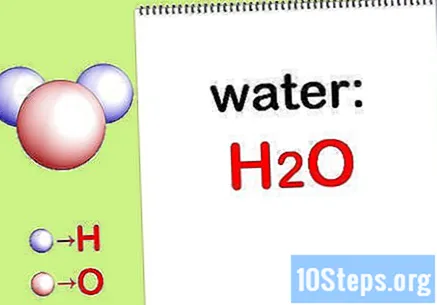
- Skriv for eksempel den kjemiske formelen for vann: H2DE.
Finn massen til hvert element i forbindelsen. Se etter molekylvekten til hvert grunnstoff i kjemiske formler ved å referere til det periodiske systemet. Generelt kan massen til et element bli funnet under symbolet for kjemiske elementer. Legg merke til massene til hvert element av forbindelsen.
- For eksempel er den molekylære massen av oksygen 15.9994, og den for hydrogen er 1.0079.
Multipliser massene med molforholdet. Identifiser hvor mange mol av hvert grunnstoff som er i den kjemiske forbindelsen. Antall mol er gitt av det abonnerte nummeret på forbindelsen. Multipliser molekylmassen til hvert element med molforholdet.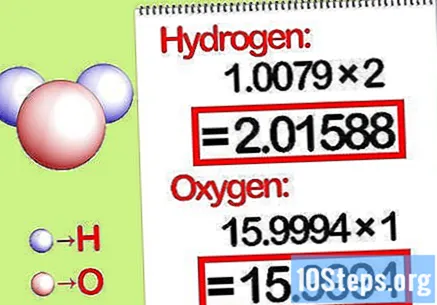
- For eksempel er molforholdet mellom hydrogen og oksygen i vann 2: 1. Multipliser derfor hydrogenets molekylvekt med to (1,00794 X 2 = 2,01588) og la molekylvekten til oksygen være slik den er (15.9994).
Beregn den totale massen av forbindelsen. Legg til den totale massen av alle elementene i forbindelsen. Ved å bruke massene beregnet av molforholdet, er det mulig å beregne den totale massen av forbindelsen. Dette tallet vil være nevner for den prosentvise masseligningen.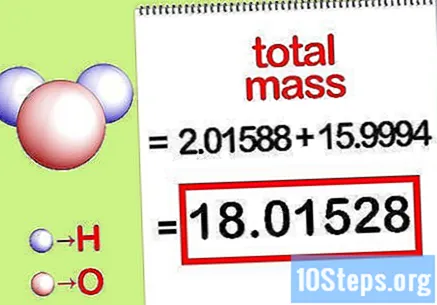
- For eksempel tilsett 2.01588 g / mol (massen av to mol hydrogenatomer) med 15.9994 g / mol (massen av en enkelt mol av et oksygenatom) og få 18,01528 g / mol.
Identifiser massen til det aktuelle elementet. Når du trenger å finne prosentmasse, vil problemet at du skal finne massen til et bestemt element i en forbindelse som en prosentandel av den totale massen til alle elementene. Identifiser massen til det aktuelle elementet og skriv den ned. Det er masseverdien beregnet ved hjelp av molforholdet. Denne verdien er telleren for den prosentvise masseligningen.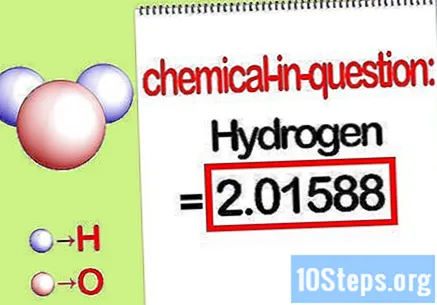
- For eksempel er hydrogenmassen til forbindelsen 2,01588 g / mol (massen av to mol hydrogenatomer).
- Erstatt variablene i den prosentvise masseformelen. Etter å ha bestemt verdiene for hver variabel, erstatt dem i ligningen definert i første trinn: prosentmasse = () x 100.
- For eksempel: prosentmasse = () x 100 = () x 100.
Beregn den prosentvise massen. Nå som ligningen er dannet, er det bare å løse den for å beregne den prosentvise massen. Del massen til elementet med den totale massen av forbindelsen og multipliser med 100. Resultatet vil være den prosentvise massen til det kjemiske elementet.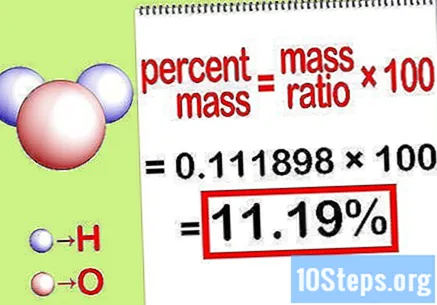
- For eksempel, prosentmasse = () x 100 = 0,1111189 x 100 = 11,18%. Dermed er den prosentvise massen av hydrogenatomer i et vannmolekyl 11,18%.