
Innhold
Andre seksjonerHydrogen er det letteste elementet og har mange industrielle bruksområder, inkludert dannelse av hydrogenerte fettstoffer til bruk på kjøkkenet og produksjon av hydrokarboner fra kull. Det er en viktig del av vannmolekyler og kan skilles ut med en liten mengde strøm. Du kan også produsere hydrogengass ved bruk av noen aktive metaller og sterke syrer. Begge metodene er relativt enkle og lar deg samle hydrogengass.
Fremgangsmåte
Metode 1 av 2: Bruk vanndisplacement med aktive metaller
Samle de nødvendige materialene. For å samle hydrogen ved hjelp av reaksjonen med å blande en sterk syre med et aktivt metall, trenger du: en Erlenmeyer-kolbe, en gummipropp, plastrør, destillert vann, reagensglass, en stor beholder, 3 molar saltsyre (HCl) og magnesium- eller sinkpellets.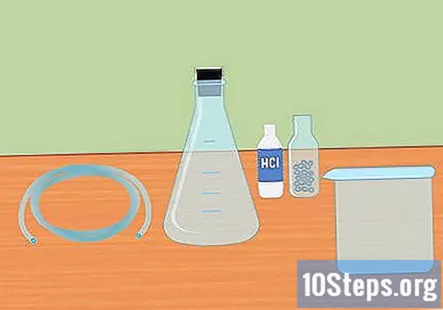
- En Erlenmeyer-kolbe er en glasskolbe som har en konisk bunn og sylindrisk hals.
- Gummiproppen er for toppen av kolben og må ha et hull i midten for at slangen skal gå gjennom.
- Enten magnesium eller sink vil fungere for dette eksperimentet, du trenger ikke begge deler.
- Noen av disse forsyningene må kanskje kjøpes online eller i en laboratoriebutikk.

Bruk riktig verneutstyr. Når du arbeider med en sterk syre som saltsyre, vil du sørge for at du tar riktige sikkerhetsforanstaltninger. Bruk en laboratoriekåpe, hansker, sko med lukket tå og øyevern er viktig.- Briller bør vikles rundt øynene for å beskytte dem mot sprut.
- Bruk hansker som passer ordentlig, slik at du opprettholder god fingerferdighet i hender og fingre.
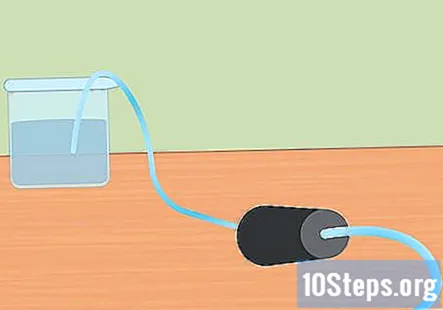
Forbered det eksperimentelle oppsettet. Sett den ene enden av slangen inn i hullet på gummiproppen. Du vil at slangen skal gå helt gjennom gummiproppen og stikke litt ut fra enden. Fyll den store beholderen med vann og legg den frie enden av slangen i vannet. Når eksperimentet begynner, vil du sette gummiproppen i Erlenmeyer-kolben.- Legg disse bitene til side til du er klar til å bruke dem.
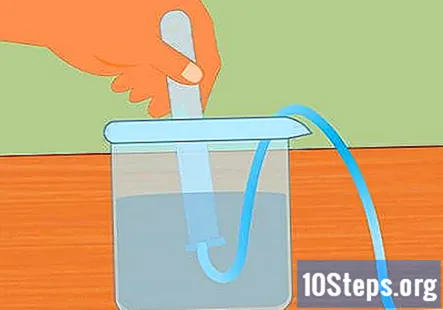
Senk prøverøret i vannet. Ta minst ett reagensglas (du kan bruke mer hvis du vil samle mer hydrogen) og senk det i vannet. Vipp røret slik at alle luftboblene kan unnslippe. Plasser røret på toppen av nedsenket rør festet til gummiproppen i motsatt ende.- Det er viktig at alle luftbobler fjernes fra røret før du begynner. Hvis de ikke er det, vil gassen som er samlet i røret være mer enn bare hydrogen.
Tilsett saltsyre i Erlenmeyer-kolben. Tilsett nok saltsyre til å fylle kolben omtrent halvveis. Cirka 100 ml bør være tilstrekkelig. Forsikre deg om at kolben er ren og tørr før du tilsetter syren. Bruk gummihansker og vær forsiktig når du fyller kolben.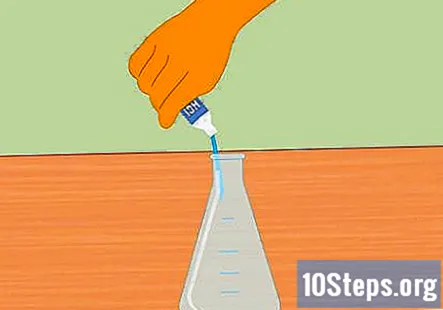
- Pass på å ikke søle vann i syren. Vann tilsatt syre kan føre til eksplosjon og personskade.
Start den kjemiske reaksjonen ved å legge metallpellets til HCl. Tilsett en håndfull sink- eller magnesiumpellets til saltsyren i kolben. Det nøyaktige beløpet du legger inn er ikke viktig, men en liten håndfull skal være nok til å starte reaksjonen.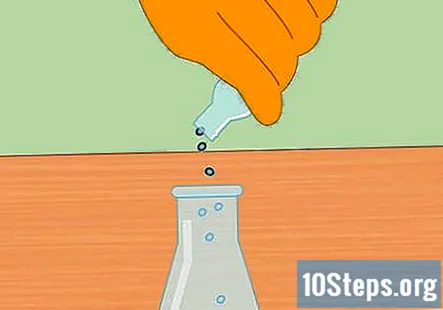
- Etter at du har tilsatt pellets, plasserer du proppen i kolben slik at systemet nå er lukket.
Samle hydrogenet i et nedsenket reagensglas. Når metallet reagerer med syren, produseres hydrogengass. Dette hydrogenet går til toppen av kolben, gjennom slangen og inn i reagensrøret nedsenket i vannet. Gassen vil fortrenge vannet, og du bør se en bobleform på toppen av prøverøret.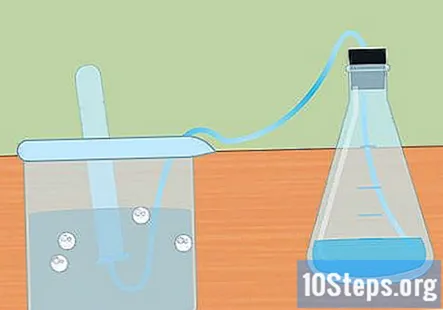
- Når reagensglasset fylles med hydrogen, senk et annet rør med vann og legg det over slangen. Du kan samle så mye hydrogen som produseres av reaksjonen din.
- Hold prøverørene vendt ned for å forhindre at hydrogengassen renner ut i luften.
Bekreft at gassen er hydrogen. For å bekrefte at gassen er hydrogen, kan du gjøre det som kalles skinne-test. Tenn en fyrstikk og hold den under røret. Du vil høre en "pop" eller knirkende lyd som indikerer at hydrogen er til stede.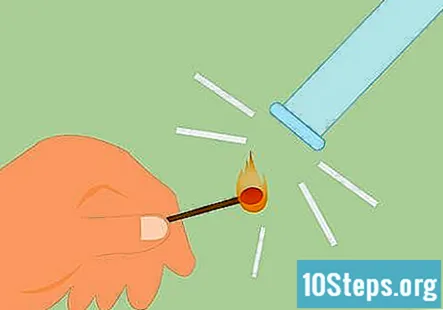
Metode 2 av 2: Bruk av elektrolyse
Samle de nødvendige materialene. I dette eksperimentet vil du bruke elektrisitet til å skille hydrogen og oksygengasser fra vannmolekyler. For å samle hydrogengass ved hjelp av elektrolyse, trenger du et 9-volts batteri, en blyant, to reagensglas, en plastbeholder, vann, natron, to store gummibånd (valgfritt) og en batteriklips med klemmer på enden.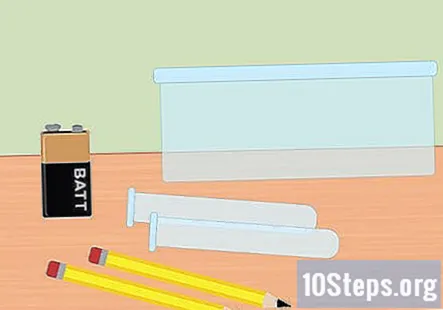
- Blyanten må ha grafitt for at dette skal fungere. En blyant nummer 2 er perfekt. To små biter av grafitt vil også fungere for dette.
- En liten oppbevaringsbeholder eller bolle er tilstrekkelig.
- Forsikre deg om at batteriklemmen kan passe til et 9-volts batteri, og at den har en rød og svart ledning med krokodilleklemmer på slutten. Disse klemmene vil bli brukt til å koble systemet til batteriet.
Fjern viskelæret fra blyanten og del blyanten i to. Du trenger to stykker grafitt, en for den positive enden av batteriet og den negative enden av batteriet. Slip begge ender av hvert stykke blyant til et punkt. Forsikre deg om at grafitten er godt eksponert.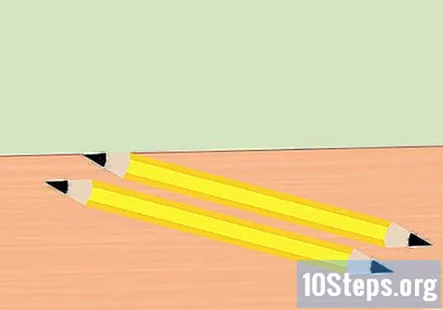
- Dette trinnet kan hoppes over hvis du allerede har to stykker ren grafitt.
Pakk 2 strikker rundt beholderen i en X-form. Dette trinnet er valgfritt, men er en enkel måte å holde prøverørene på plass mens eksperimentet kjører. Strekk det ene gummistrikket over beholderen og strekk et gummistrikk over det slik at det krysser over det første og danner et X.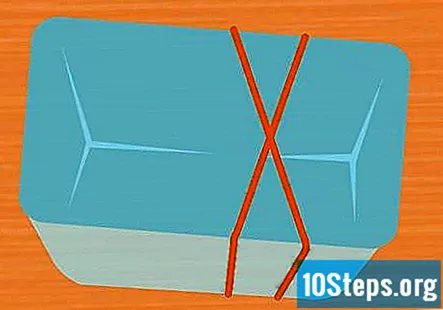
- Hvis du ikke bruker gummistrikk, må du sørge for å sikre prøverørene med tape eller snor slik at de holder seg opp ned under eksperimentet.
Lag en natron og vannløsning. Å oppløse natron i vann vil hjelpe strømmen til å bli ledet i systemet. Den nøyaktige mengden natron som er tilsatt er ikke viktig, men omtrent 1 ts per 1 kopp vann bør være tilstrekkelig. Rør til den er helt oppløst.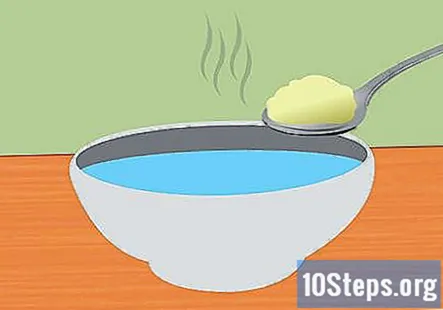
- Bruk varmt vann for å øke oppløsningen av natron.
Fyll plastbeholderen og reagensglassene med natronoppløsningen. Beholderen må være stor nok til å holde begge prøverørene. Tilsett nok av løsningen for å fylle beholderen omtrent tre fjerdedeler full. Senk prøverørene i oppløsningen av beholderen og snu dem opp ned. Plasser hvert rør i krysset av gummistrikket X for å holde det på plass.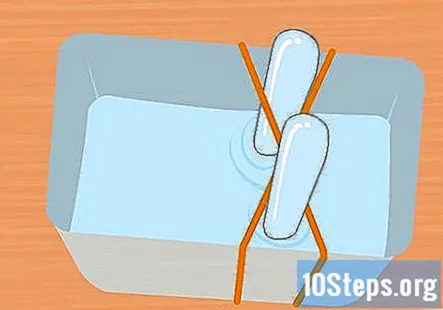
- Det er veldig viktig at begge prøverørene er full av vann og at det ikke er igjen noen luftbobler.
Fest alligatorklemmene til grafitten. Ta en klemme fra batteriklemmen og fest den til enden av en av blyantene. Forsikre deg om at den berører så mye av grafitten som mulig. Gjør det samme med den gjenværende alligatorklemmen og blyantstykket.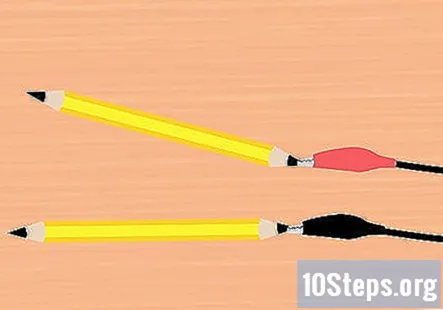
- En blyant skal festes til den røde klemmen og en blyant til den svarte klemmen.
Skyv den uklemte enden av blyanten inn i prøverøret. Hold prøverøret helt nedsenket, og vipp det litt slik at du kan skyve den uklemmede enden av blyanten inn i røret. Gjenta denne prosessen med den andre blyanten og den andre reagensglasset.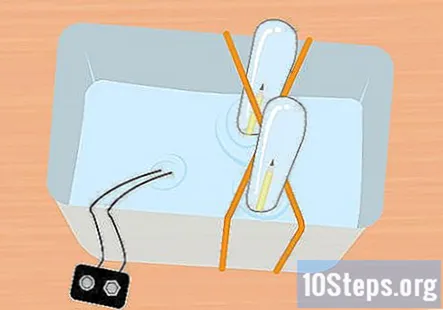
- På dette tidspunktet skal alt være under vann, og det skal være ett blyant inni hvert prøverør.
- Hold enden av batteriklemmen som festes til batteriet, ut av vannet.
Fest batteriklemmen til 9-volts batteriet. Når alt er satt opp, er du nå klar til å bruke strømmen fra 9-volts batteriet. Enden av batteriklemmen skal stikke ut av beholderen, så bare klem batteriet på plass. Når batteriet er festet, bør du legge merke til at det stiger bobler fra enden av grafitten og flyter til toppen av hvert prøverør.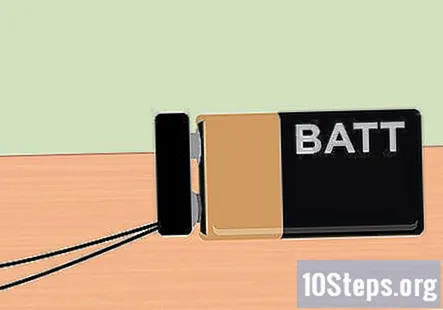
- Hvis du ikke ser bobler produsert, må du kontrollere at krokodilklemmene er festet godt til grafitten på blyanten. Kontroller også at batteriet er fulladet.
- Testrøret med den negative ledningen festet til blyanten vil produsere hydrogen, mens reagensrøret festet til den positive ledningen til batteriet vil produsere oksygen.
Samle hydrogen og oksygen i de to reagensglassene til du har noen centimeter gass i hvert rør. Husk at røret som er koblet til den negative enden av batteriet, vil ha hydrogen og oksygen vil være i røret som er koblet til den positive enden. Fjern prøverørene fra glasset, ett om gangen. Hold dem opp ned og la vannet renne ut. Gassen i rørene vil forbli, selv om du ikke kan se den.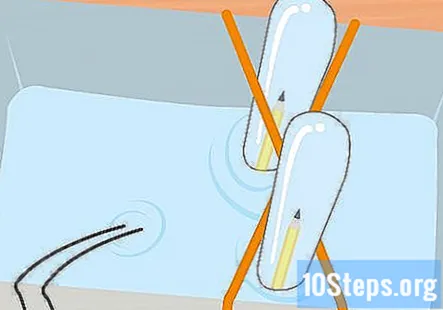
Test for tilstedeværelse av hydrogen. Du kan teste for tilstedeværelse av hydrogen ved å slå en fyrstikk og holde flammen opp mot gassen. Det vil gi en veldig tydelig "knirkende pop" -lyd hvis det er hydrogen. Du kan også bruke et tent lys i stedet for en fyrstikk.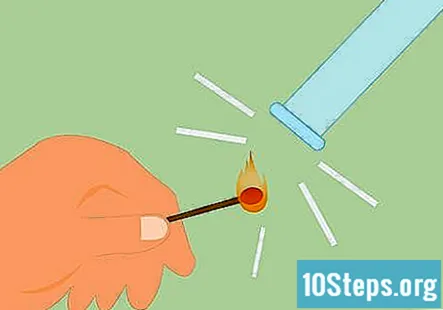
- For å teste for oksygen i prøverøret som var koblet til den positive siden av strømkilden, blåser du ut en tenn fyrstikk (eller stearinlys) og plasserer den fremdeles glødende enden under reagensrøret. Hvis lyset tennes igjen, er oksygen tilstede.
Samfunnsspørsmål og svar
Trenger jeg to prøverør hvis jeg bare vil samle hydrogen?

Miljøforsker Bess Ruff er stipendiat i geografi ved Florida State University. Hun tok sin MA i miljøvitenskap og ledelse fra University of California, Santa Barbara i 2016. Hun har utført kartleggingsarbeid for marin fysisk planleggingsprosjekter i Karibia og gitt forskningsstøtte som utdannet stipendiat for Sustainable Fisheries Group.

Hvor mye hydrogen kan samles fra dette enkle eksperimentet med elektrolyse? Og hva ville være trykket til hydrogengassen?
Det kommer an på. Reaksjonshastigheten (splitting av vann) er basert på batteriets forsterkere og tiden som er igjen for å reagere. Vanligvis vil hydrogenet være på omtrent havnivåtrykk med mindre du gjør eksperimentet i et veldig varmt eller kaldt miljø.
Hvorfor samler hydrogenet seg i det negative røret
På grunn av måten vannmolekylene deler elektroner på, er hydrogenatomene positivt ladet og oksygenatomene er negativt ladet. Når du trekker ut gassene, vil det positivt ladede hydrogenet bli tiltrukket av det negative røret, mens det negativt ladede oksygenet vil bli tiltrukket av det positive røret.
Hvorfor rømte ikke gassen fra gassoppsamlingsrøret mitt?
Det er hydrogen, en gass som er lettere enn alle andre, inkludert helium, noe som betyr at den vil forbli i reagensrøret så lenge den lukkede enden av røret er på toppen fordi de andre gassene fortrenger det. Grunnen til at vi bruker helium i stedet for hydrogen er at det ikke er brannfarlig. Dette skyldes det faktum at det er en edelgass (den har et fullt valensskall på 8 elektroner) og er derfor ikke reaktiv.
Ville gassen være veldig brannfarlig?
Ja. Se Hindenburg-katastrofen på YouTube. Zeppelinene brukte hydrogen på grunn av at det var den letteste gassen og ganske lett å få tak i. Det er også grunnen til at noen bilprodusenter jobber med hydrogendrevne biler.
er dette den flytende formen av hydrogen?
Nei - hydrogenet i dette eksperimentet vil være gassformig
Hvordan gjør jeg flytende hydrogen? Svar
Advarsler
- Vær forsiktig med rent hydrogen. Det er svært eksplosivt når det blandes med luft.
- Forsikre deg om at all annen luft er fjernet fra utstyret du samler hydrogen i.


