Innhold
Selv om alle atomer med samme element inneholder samme antall protoner, kan antall nøytroner variere. Å vite hvor mange nøytroner et bestemt atom har, kan hjelpe deg med å bestemme om partikkelen er regelmessig i det elementet eller en isotop, som vil ha mer eller mindre nøytroner. Å bestemme antall nøytroner i et atom er ganske enkelt og krever ikke noe eksperiment. For å beregne antall nøytroner i et vanlig atom eller isotop, følg disse instruksjonene med en periodisk tabell i hånden.
Steps
Metode 1 av 2: Finne antall nøytrale i et vanlig atom
Finn elementet i den periodiske tabellen. For dette eksemplet, la oss se på OS (Os), som er i den sjette raden, fra topp til bunn.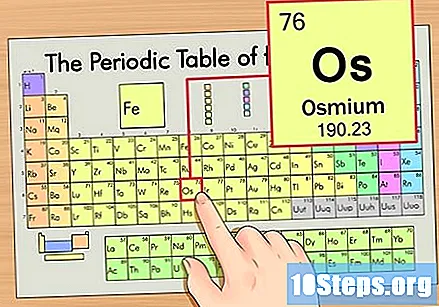
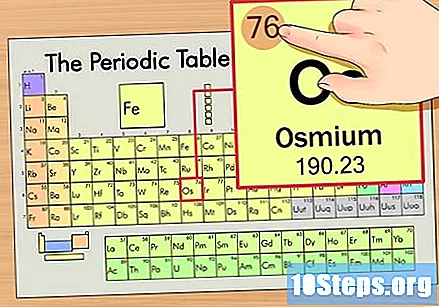
Finn elementets atomnummer. Dette er vanligvis det mest synlige tallet for et bestemt element og er vanligvis over symbolet (i tabellen vi bruker er det faktisk ikke noe annet nummer). Atomnummeret er antallet protoner i et enkelt atom i det elementet. Antallet Os er 76, noe som betyr at et Osmium-atom har 76 protoner.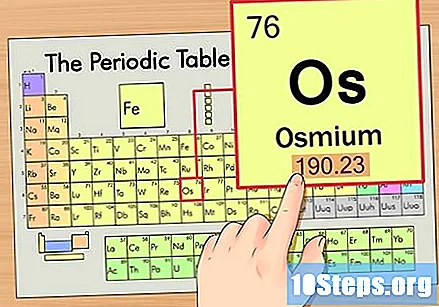
Finn elementets atomvekt. Dette tallet finnes vanligvis under atomsymbolet. Merk at tabellen i dette eksemplet bare er basert på atomnummeret og ikke viser atomvekten. Dette vil ikke alltid være tilfelle. Osmium har en atomvekt på 190,23.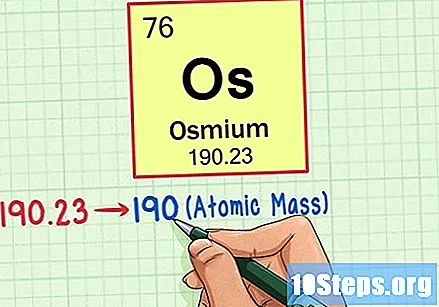
Rund atomvekten til nærmeste hele tall for å finne atommassen. I vårt eksempel ville 190.23 bli avrundet til 190, noe som resulterte i en atommasse på 190 for Osmium.- Atommasse er et gjennomsnitt av elementets isotoper. Derfor er det vanligvis ikke et helt tall.
Trekk atomnummeret fra atommassen. Siden det store flertallet av atommets masse finnes i dets protoner og nøytrale, vil du trekke antallet protoner (det vil si atomtallet) fra atommassen, gi deg tallet regnet ut av nøytroner i atomet. Tallet etter desimaltallet representerer generelt en veldig liten masse elektroner i atomet. I vårt eksempel er dette: 190 (atommasse) - 76 (antall protoner) = 114 (antall nøytroner).
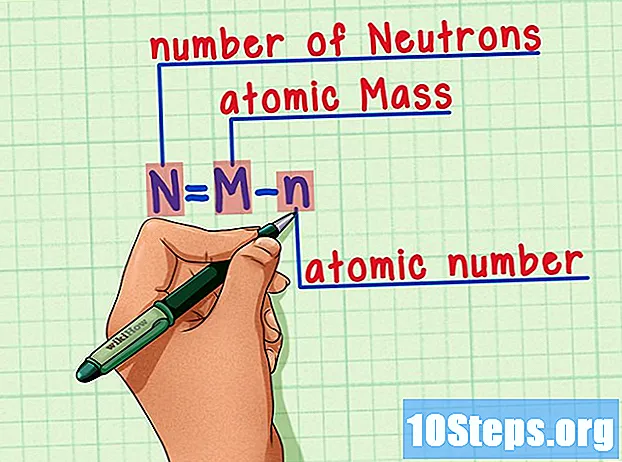
Husk formelen. For å finne antall nøytroner i fremtiden, bruk bare denne formelen: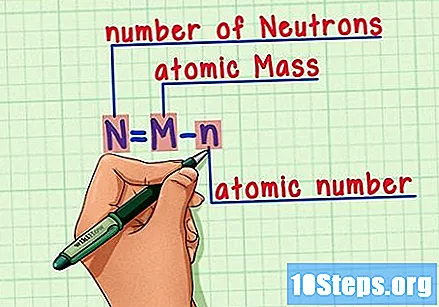
- N = M - n.
- N = antall Neutrons.
- M = Matomsteke.
- n = natom humerus.
- N = M - n.
Metode 2 av 2: Finne antall nøytroner i en isotop
Finn elementet i den periodiske tabellen. La oss for eksempel bruke karbon-14 isotopen. Siden den ikke-isotopiske formen for karbon-14 ganske enkelt er karbon (C), finn dette elementet i den periodiske tabellen (i andre rad).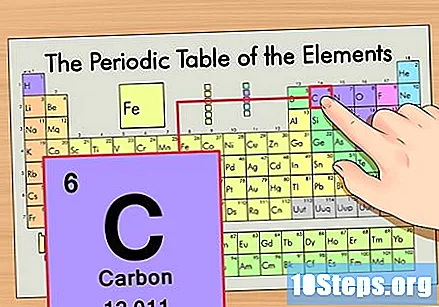
Finn elementets atomnummer. Dette er vanligvis det mest synlige tallet for et bestemt element og er vanligvis over symbolet (i tabellen vi bruker er det faktisk ikke noe annet nummer). Atomnummeret er antallet protoner i et enkelt atom i det elementet. C er nummer 6, noe som betyr at et karbonatom har 6 protoner.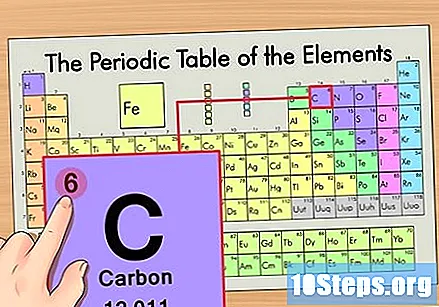
Finn atommassen. Dette er utrolig enkelt med isotoper, da de er oppkalt etter sin atommasse. Carbon-14 har en atommasse på 14. Når du har funnet atommassen til isotopen, er prosessen for å finne antall nøytroner den samme som brukes for vanlige atomer.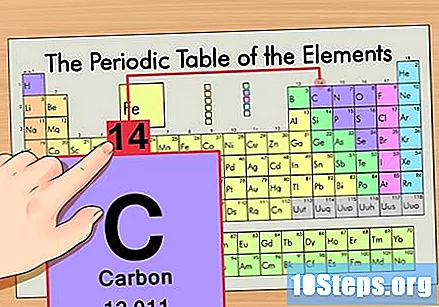
Trekk atomnummeret fra atommassen. Siden det store flertallet av atommets masse finnes i dets protoner og nøytrale, vil du trekke antallet protoner (det vil si atomtallet) fra atommassen, gi deg tallet regnet ut av nøytroner i atomet. Tallet etter desimaltallet representerer generelt en veldig liten masse elektroner i atomet. I vårt eksempel er dette: 14 (atommasse) - 6 (antall protoner) = 8 (antall nøytroner).
Husk formelen. For å finne antall nøytroner i fremtiden, bruk bare denne formelen: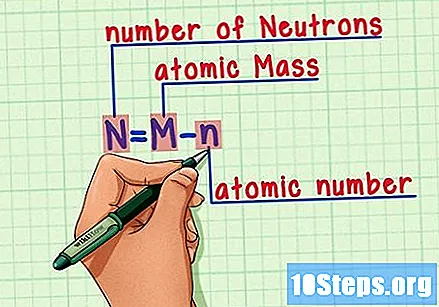
- N = M - n.
- N = antall Neutrons.
- M = Matomsteke.
- n = natom humerus.
- N = M - n.
Tips
- Osmium, et fast metall ved romtemperatur, henter navnet fra det greske ordet for 'lukt', 'osme'.
- Protoner og nøytroner utgjør nesten hele elementenes vekt, mens elektroner og andre forskjellige partikler representerer en ubetydelig masse (nærmer seg null masse). Siden et proton har omtrent samme vekt som et nøytralt og atomnummeret representerer antall protoner, kan vi ganske enkelt trekke fra antall protoner fra den totale massen.
- Hvis du ikke er sikker på hvilket antall som er i den periodiske tabellen, bare husk at det vanligvis er laget rundt atomnummeret (det vil si antall protoner), som starter med 1 (Hydrogen) og går opp en enhet pr. venstre mot høyre, og slutter på 118 (Ununóctio). Dette fordi antallet protoner i et atom bestemmer hva atomet er, noe som gjør det lettere å organisere elementkarakteristikken (for eksempel vil et atom med 2 protoner alltid være Helium, akkurat som et annet atom med 79 protoner vil alltid være Gull).


